Meccanismi molecolari alla base dell’autorinnovamento e differenziamento di cellule staminali epiteliali
Vincenzo Prof. Calautti
Sommario dei principali risultati scientifici recenti
Segnali a valle di della serina-treonina chinasi Akt possono favorire o sfavorire il mantenimento di cellule staminali, ma come questo doppio ruolo agisca in maniera contesto-dipendente è ancora da definire. Abbiamo dimostrato in precedenza che Akt fornisce un segnale di sopravvivenza essenziale per cheratinociti epidermici in via di differenziamento, a valle di E-Caderina e delle tirosina-chinasi tipo-Src e del recettore per l’EGF (Calautti E. et al., 2005). Più recentemente, utilizzando cheratinociti staminali limbari umani, un tipo di cellule staminali gia’ utilizzate in protocolli di trapianto per la rigenerazione corneale, abbiamo dimostrato che il segnale di Akt è prominente nella popolazione di cellule staminali sia in vivo che in vitro, e che tra i membri della famiglia di Akt (Akt1, Akt2 e Akt3), Akt1 promuove, mentre Akt2 contrasta l’autorinnovamento delle cellule staminali, dal momento che la perdita del segnale di Akt2 aumenta il self-renewal dei cheratinociti staminali limbari ex vivo, mentre la deplezione di Akt1 anticipa l’esaurimento delle cellule staminali. Da un punto di vista meccanicistico, la funzione antagonistica di Akt1 e Akt2 nel controllo delle staminali è principalmente dettata dalla loro differenziale distribuzione all’interno della cellula, essendo Akt2 l’isoforma di Akt con preferenziale localizzazione nucleare, e dunque implicata selettivamente nell’inibizione dei fattori trascrizionali FOXO, necessari per proteggere le cellule da varie forme di stress. La diminuzione di Akt2 favorisce il mantenimento di cheratinociti staminali limbari come risultato di un incremento delle funzioni dei fattori trascrizionali FOXO, che a loro volta attenuano la via di segnalazione del Complesso proteico denominato “Mechanistic Target of Rapamycin 1” (mTORC1), attraverso l’induzione del gene tubero sclerosi 1 (TSC1), e promuovono le vie di segnalazione dipendenti da fattori di crescita mediante attivazione di Akt1. Infine, abbiamo anche dimostrato che la mancanza di Akt2 in un modello murino aumenta il numero di cellule staminali limbari in vivo (Saoncella S. et al., 2013). Dunque, le nostre scoperte rivelano per la prima volta ruoli distinti per la frazione nucleare rispetto a quella citoplasmatica della via di segnalazione di Akt nel controllo delle cellule staminali epiteliali normali, e suggeriscono che l’inibizione selettiva di Akt2 possa fornire una nuova strategia farmacologia per l’espansione di cheratinociti staminali limbari umani in ambito terapeutico.
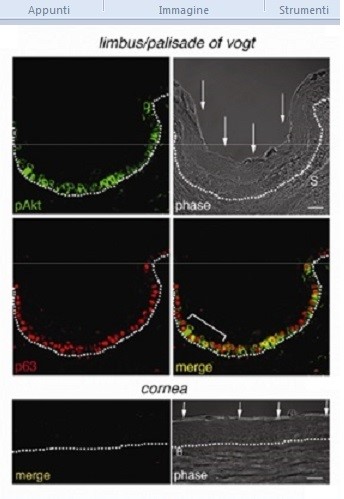
La via di segnalazione di Akt è attiva nella nicchia di cellule staminali limbari umane in vivo.
Analisi al microscopio confocale di epitelio umano limbare e corneale con l’anticorpo anti phospho-Ser473 Akt (pAkt, verde), che riconosce le proteine Akt attive, e gli anticorpi contro il marker di cellule staminali limbari epiteliali p63 (p63, rosso). Da notare che la maggior parte di cellule pAkt+ coincide con cellule con alti livelli di p63 nello strato basale del limbus. Da notare che l’epitelio corneale centrale, che è privo di cellule staminali epiteliali, manca della colorazione sia per p63 che per pAkt.
Progetti in corso
1) Ruolo delle isoforme di Akt nelle cellule staminali epiteliali normali e cancerose.
Le nostre scoperte secondo le quali Akt2 si oppone alle funzioni di cellule staminali normali epiteliali sono apparentemente in contrasto con la nozione che in cellule umane immortalizzate di tumore alla mammella, la proteina Akt2 favorisca la formazione de novo di cellule staminali cancerose. I nostri studi recenti suggeriscono infatti che le diverse isoforme di Akt possano avere ruoli distinti in cellule staminali epiteliali normali o in linee cellulari immortalizzate e/o trasformate che hanno già oltrepassato meccanismi “fail-safe” di soppressione tumorale.
Stiamo correntemente testando questa possibilità con una combinazione di approcci funzionali e molecolari sia in vitro che in vivo, utilizzando cellule epiteliali primarie umane, così come linee cellulari epiteliali umane immortalizzate o tumorali, nelle quali la via di segnalazione delle isoforme di Akt è stata sperimentalmente manipolata. Come approccio complementare, stiamo anche analizzando le funzioni di cellule staminali normali e cancerose derivate da animali mancanti di Akt1 o Akt2 in condizioni omeostatiche, o nel contesto della progressione tumorale.
2) Ruolo di Rictor nell’omeostasi dell’epidermide e nella carcinogenesi.
Segnali cellulari originati dall’attivazione della serina treonina chinasi Mechanistic Target di Rapamicina (mTOR) svolgono funzioni essenziali sia nella biologia di cellule normali che nella progressione tumorale. mTOR e’ in grado di nucleare due distinti complessi proteici, rispettivamente mTOR complex 1 (mTORC1) e mTOR complex 2 (mTORC2), che segnalano a valle e a monte delle isoforme di Akt, rispettivamente.
mTORC2, in particolare, fosforila il sito regolatorio in Serina all’interno del dominio idrofobico di Akt, ed in questo modo contribuisce alla completa attivazione enzimatica di Akt. Rictor è una proteina essenziale per la formazione di mTORC2, e la mancanza del gene rictor è letale durante la vita embrionale. Per definire i ruoli di Rictor in condizioni omeostatiche o carcinogenesi dell’epidermide, abbiamo generato un topo condizionale knockout con una delezione di rictor specifica nell’epidermide, incrociando topi con un alle “floxed” di Rictor con topi esprimenti la Cre ricombinasi sotto il controllo del promotore endogeno della keratina 14. L’analisi molecolare e funzionale di cheratinociti di epidermide mancanti di Rictor e’ attualmente in corso.
Gruppo di ricerca
- Vincenzo Calautti, Ricercatore
- Stefania Saoncella, post-Doc
- Beatrice Tassone, PhD student
Pubblicazioni selezionate
- Saoncella S, Tassone B, Deklic E, Avolio F, Jon C, Tornillo G, De Luca E, Di Iorio E, Piva R, Cabodi S, Turco E, Pandolfi PP, Calautti E. Stem Cells. 2013 Oct 7.
- Paina S, Garzotto D, DeMarchis S, Marino M, Moiana A, Conti L, Cattaneo E, Perera M, Corte G, Calautti E, Merlo GR. J Neurosci. 2011 Feb 16;31(7):2675-87
- Roberts S*., Calautti E.*, Vanderweil S. , Nguyen HO., Foley A., Baden HP., and Viel A. (2007). “Changes in localization of human discs large (hDlg) during keratinocyte differentiation is associated with expression of alternatively spliced hDlg variants. Exp Cell Research 313, 2521 – 2530.
- Li J, Baxter RM, Weiner L, Goetinck PF, Calautti E, Brissette JL. Differentiation. 2007 Oct;75(8):694-701.
- Grossi M, Hiou-Feige A, Tommasi Di Vignano A, Calautti E, Ostano P, Lee S, Chiorino G, Dotto GP. Proc Natl Acad Sci U S A. 2005 Aug 9;102(32):11313-8.
- Calautti E, Li J, Saoncella S, Brissette JL, Goetinck PF. J Biol Chem. 2005 Sep 23;280(38):32856-65
- Calautti E, Grossi M, Mammucari C, Aoyama Y, Pirro M, Ono Y, Li J, Dotto GP. J Cell Biol. 2002 Jan 7;156(1):137-48.